1株禽大肠杆菌噬菌体的分离及杀菌效果评估
发布时间:2022-05-19所属分类:农业论文浏览:1次
摘 要: 摘 要:【目的】探索噬菌体作为控制养殖环境致病性大肠杆菌的新手段。【方法】本研究进行了大肠杆菌噬菌体的分离及相应指标评估。通过双层平板法从养殖环境中分离禽致病性大肠杆菌裂解性噬菌体。通过电镜及酶切鉴定、温度及酸碱稳定性、最佳感染复数、一步生长曲线及其
摘 要:【目的】探索噬菌体作为控制养殖环境致病性大肠杆菌的新手段。【方法】本研究进行了大肠杆菌噬菌体的分离及相应指标评估。通过双层平板法从养殖环境中分离禽致病性大肠杆菌裂解性噬菌体。通过电镜及酶切鉴定、温度及酸碱稳定性、最佳感染复数、一步生长曲线及其在模拟环境中的杀菌效果对该噬菌体进行综合性评估。【结果】分离得到的噬菌体具有正多面体的头部和细而长的尾部结构,头部直径约98nm,尾部长约123nm,结合酶切鉴定结果初步判定该噬菌体为肌尾科双链 DNA 噬菌体。该噬菌体的温度耐受范围为37~50 ℃;酸碱耐受范围为pH3.0~11.0。当感染复数为0.00001时产生的子代噬菌体滴度最高;一步生长曲线测定结果显示,该噬菌体潜伏期为20~40min,裂解时间为80~100min,裂解量为4133PFU/cell。从该噬菌体对模拟环境中宿主大肠杆菌的杀菌效果可看出,浓 度 为 1×104 ~1×106 PFU/mL 的 噬 菌 体 ФECP2-1对液体中目标大肠杆菌作用1~6h,杀菌率均在99.9%以上;浓度为2×104~2×106 PFU/g的 噬菌 体 ФECP2-1对鸡粪中目标大肠杆菌作用5~10h,杀菌率均在99%以上,该噬菌体对鸡粪中目标大肠杆菌杀菌效果略低于对液体中目标大肠杆菌的杀菌效果。【结论】ФECP2-1符合噬菌体类消毒剂相关特征,是一株具有良好应用前景的噬菌体,可作为一种生物消毒剂应用于养殖环境中禽大肠杆菌的防控。
关键词:禽大肠杆菌;裂解性噬菌体;生物学特性;杀菌效果
禽致病性大肠杆菌(avianpathogenicEscherichiacoli,APEC)是一种肠外致病性大肠杆菌,可引起禽类大肠杆菌病,并常与其他呼吸道疾病混合感染,引发禽类腹膜炎、肝周炎、心包炎等病变,严重的可引发败血症,导致禽类死 亡[1-2]。此 外,禽大 肠 杆 菌 病不仅会降低禽类生产性能,提高死亡率,与其他疾病混合感染还会加重病情,降低疫苗免疫效力[3]。
目前国内外防治禽大肠杆菌病的主要手段仍为抗生素,但抗生素的长期使用所引发的药物残留等食品安全问题及产生耐药菌等问题已引起了广泛关注[4-5]。因此,亟需开发安全、高 效 的 禽 大 肠 杆 菌 病防治手段。鉴于该病的自然感染途径主要通过呼吸系统及消化系统两方面单独或协同诱发,从调控养殖环境中致病性大肠杆菌的数量入手,对于防控该病的发病率具有重要的生物安全意义。
噬菌体作为一种专一侵袭目标细菌的病毒,具有繁殖迅速、特 异 性 强 的 优 势,能快速裂解目标菌株,从而达到杀菌的目的。自被发现至今一百多年的时间里,研究者一直尝试着将其作为新型抗菌剂应用于病原菌的防控,且有些已在国外获批上市[6]。大量研究表明,噬菌体对人及动 物 是 安 全 的[7-9],噬菌体作为一种可替代抗生素的生物制剂及环境改良剂,具有广阔的应用前景。
本研究以 O2血清型禽大肠杆菌为研究对象,从养殖环境中分离相应的噬菌体,并对噬菌体的生物学特性及环境杀菌效果进行综合评估,以期为噬菌体制剂的推广应用提供科学依据。
1 材料与方法
1.1 材料
1.1.1 菌 株
宿 主 菌 O2 血 清 型 禽 大 肠 杆 菌CVCC1552购自中国兽医药品监察所菌种保藏中心。
1.1.2 主要试剂及仪器
胰 蛋白 胨 大 豆 肉 汤(TSB)培养基、胰蛋白胨大豆琼脂(TSA)培养基均购自青岛高科技工业园海博生物技术有限公司;Tris-HCl缓 冲 溶 液 购 自 北 京 索 莱 宝 科 技 有 限 公 司;PEG8000购自长春天佳生物技术有限公司;氯仿购自重庆川东化工有限 公 司;DNase Ⅰ、RNaseA、微量病 毒 提 取 试 剂 盒、限 制 性 核 酸 内 切 酶 EcoRⅠ、HindⅢ均购自宝生物工程(大连)有限公司;0.22μm微孔滤膜购自PALL公司。超净工作台、电热恒温培养箱、恒温振荡培养箱等均购自山东博科科学仪器有限公司;PhilipsTecnai10透射式电镜购自Philips公司。
1.2 方法
1.2.1 噬菌体的分离纯化
于山东省泰安市某鸭场 粪 池 采 集 粪 便 样 品。将 采 集 到 的 样 品 加 入15mL50mmol/LTris-HCl缓冲溶液,4 ℃静置过夜。将样品于12000r/min离心10~15min去除大部分固体杂质,上清液经0.22μm 微孔滤膜过滤除菌。取10mL过滤液加入10mL已灭菌 TSB培养基中,再按照1%接种量加入对数生长期的宿主菌种子液,37 ℃、180r/min振 荡培 养 过 夜,次 日 将培养液8000r/min离心15min,取1mL上清液加入10mLTSB培养基,并按照1%接种量接种对数生长期的宿主菌种子液,室温静置1h后于37 ℃振荡培养4h,培养结束后8000r/min离心15min,过滤,即得噬菌体原液。
用50mmol/LTris-HCl缓冲溶液对噬菌体原液进行梯度稀释,取合适梯度噬菌体稀释液0.3mL与0.3mL宿主菌种子液混合,加入5mL 约55 ℃ TSB半固体培养基,混匀后倒入 TSA 平板上,平板凝固后倒置于37℃培养箱4~6h,观察噬菌斑生长情况。挑取直径 大 且 透 亮 的 噬 菌 斑 于 Tris-HCl缓冲溶液,适当稀释后按照前述分离方法进行纯化,重复3~5次,直至噬菌斑形状大小均匀。挑取单个噬菌斑至10mLTSB培养基,并按照1%接种量接种对数生长期的宿主菌液,37 ℃、180r/min振荡培养过夜;离心过滤后即得纯化的噬菌体裂解液,同时参照文献方法进行噬菌体滴度测定[10]。
1.2.2 噬菌体电镜观察 参照文献提供方法,采用PEG8000制备噬菌体颗粒浓缩液,取10μL浓缩液滴于铜网 上,自 然 沉 淀10min,用滤纸吸去侧面多余液体,加1滴磷钨酸至铜网上,染色10min,铜网干燥后用透射电镜进行观察[11]。
1.2.3 基因组提取及核酸类型 确 定
利 用PEG8000制备噬菌体颗粒浓缩液,在浓缩液中加入DNaseⅠ、RNaseA,37 ℃孵育30min,采用微量病毒提取试剂盒提取噬菌体核酸。用限制性核酸内切酶EcoRⅠ、HindⅢ 对提取到的噬菌体核酸进行酶切,酶切产物用0.7%琼脂糖凝胶进行电泳检测,根据酶切图谱鉴定噬菌体核酸类型。
1.2.4 噬菌体生物学特性分析
1.2.4.1 噬菌谱测定
测定该噬菌体对本实验室保存的除宿主菌之外的其余10株大肠杆菌的宿主谱,10株大肠 杆 菌 于37 ℃、180r/min振 荡培 养过夜,噬菌体过滤液及大肠杆菌菌液各取100μL,加入5mLTSB半固体培养基,混匀后倒入 TSA 平板上,凝固后倒置于37 ℃培养箱4~6h,观察有无噬菌斑生长。
1.2.4.2 最佳感染复数(MOI)测定
将宿主菌培养至对数生长期,并进行活菌计数。宿主菌按照培养基体积的1%加至灭菌的 TSB液体培养基中,噬菌 体 裂 解 液 按 照 感 染 复 数 为 0.1、0.01、0.001、0.0001、0.00001、0.000001 加 入,37 ℃、180r/min振荡培养3.5h,5000r/min离心15min,上清液经0.22μm 微孔滤膜过滤除菌,梯度稀 释 法 测 定 裂 解液滴度,以产生最高滴度的感染复数组作为该噬菌体的最佳感染复数。
1.2.4.3 一步生长曲线
将噬菌体及对数生成长期的宿主菌按照最佳感染复数加至100mLTSB液体培养基中,37 ℃振 荡培 养 箱 静 置 孵 育15min 后180r/min振荡培养,每隔20min取样,测定噬菌体滴度。以时间为横坐标、噬菌体滴度为纵坐标绘制一步生长曲线图。通过下列公式计算噬菌体裂解量。
裂解量=裂解末期噬菌体滴度/裂解初 期 宿 主菌数
1.2.4.4 热稳定性测定
取1mL 噬菌体纯培养液(109 PFU/mL)置于无菌 EP管内,分别于40、50、60、70、80 ℃水浴中孵育1h 后,测定 噬 菌 体 滴度。以温度为横坐标、噬菌体滴度为纵坐标绘制温度耐受性曲线图。
1.2.4.5 酸碱稳定性测定
取噬菌体纯培养液(109 PFU/mL)按 照1:9的 比例 分 别 加 至 pH 为1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0和12.0的 Tris-HCl缓冲溶液中,37℃水浴中孵育1h 后,测定噬菌体滴度。以pH 为横坐标、噬菌体滴度为纵坐标,绘制酸碱耐受性曲线图。
1.2.5 环境杀菌效果评估
1.2.5.1 液体杀菌效果评估
制备宿主菌菌悬液,离心、缓冲液重悬后获得去培养基菌悬液,将菌悬液活菌数调整到2.0×105 CFU/mL,然后按体积比1:1加入相应噬菌体(混匀后效价分别为在1.0× 104、1.0×105、1.0×106 PFU/mL 左右),对照组加入等量 TSB培养基,25 ℃放置,分别在1和6h取样,测定宿主菌活菌数。
1.2.5.2 载体(鸡粪)杀菌效果评估
制备宿主菌菌悬液,稀释 菌 液 浓 度 到4.0×106 CFU/mL,分别以体积比1:1加入浓度为4.0×105、4.0×106、4.0×107 PFU/mL的噬菌体,混匀后取1mL 混合液滴加于已高压灭菌并烘干的10g鸡粪中,搅拌均匀(使得鸡粪含宿主菌为2.0×105 CFU/g;鸡粪含噬菌 体 分 别 为 2.0×104、2.0×105 和 2.0× 106 PFU/g),以加等量 TSB培养基为空白对照组,用玻璃 纸 密 封,于 25 ℃ 培 养 箱 放 置,分 别 在 5 和10h取样,测定宿主菌活菌数。
1.2.6 统计分析
试验数据用 Excel2010进行初步处理后,采用 SPSS23.0软件进行单因素方差分析(One-WayANOVA),并 进行 LSD 多 重比 较。结果 以 平 均 值 ± 标 准 差 表 示,P<0.05 表 示 差 异显著。
2 结 果
2.1 噬菌体的分离纯化
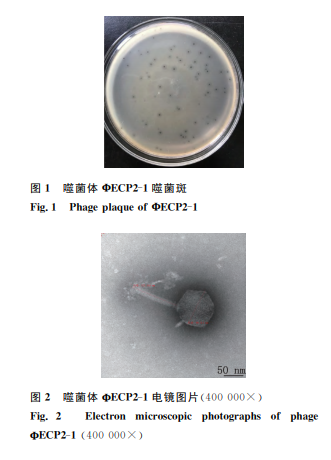
通过双 层 平 板 法 分 离 纯 化 出 1株 禽 大 肠 杆 菌(O2血清 型)噬 菌 体,命 名 为 ФECP2-1。该 噬菌 体在双层平板 上 形 成 直 径 1 mm 左 右圆 形 透 明 噬 菌斑,有较大晕圈(图1)。
2.2 噬菌体电镜观察结果
在透射电子显微镜下观察发现,该噬菌体具有正多面体的头部和细而长的尾部结构,头部直径约98nm,尾部长约123nm(图2),初步判定为肌尾科噬菌体。
2.3 基因组提取及核酸类型确定
由图3可知,噬菌体 ФECP2-1可被限制性内切酶切开,表 明 噬 菌 体 ФECP2-1 为 双 链 DNA 噬 菌体。根据酶切结果预测其基因组大小约为29kb。
2.4 噬菌体生物学特性测定结果
2.4.1 噬菌谱测定结果
对除宿主菌之外其余10 株 大 肠 杆 菌 进 行 宿 主 谱 测 定,发 现 噬 菌 体 ФECP2-1还能裂解 C8-0008、C8-0020、C8-0033、C8-0040、C8-0045、C8-0047、C8-0106、CVCC15688 株宿主菌(含与宿主 菌 不 同 血 清 型 菌 株)(表1),表 明该噬菌体还可裂解自身血清型之外的其他大肠杆菌,具有较宽的裂解谱。
2.4.2 最佳感染复数测定结果
噬菌体 ФECP2-1在感染复数为0.00001时所产生的的子代噬菌体滴度最高,为1.66×1010 PFU/mL(图4),表明噬菌体 ФECP2-1最佳感染复数为0.00001。
2.4.3 一步生长曲线测定结果
通过一步生长曲线测定发现,噬菌体 ФECP2-1感染宿主菌的潜伏期为20~40min,裂解时间为80~100min,120min后进入平台 期,噬 菌 体 最 高 滴 度 为6.20×1010 PFU/mL(图5),通 过 裂 解 量 公 式 得 出 该 噬 菌 体 裂 解 量 为4133PFU/cell。
2.4.4 热稳定性测定结果
由热稳定性曲线图可知,噬菌体 ФECP2-1在40~50 ℃滴度变化不明显,60℃处理1h,噬菌体滴度降低接近50%,60℃ 以上噬菌体滴度骤降,至80℃时基本降至0(图6)。
2.4.5 酸碱稳定性测定结果
噬菌体 ФECP2-1在 pH3.0~11.0范围内较稳定。强酸、强 碱 都 会造成噬菌体活性 降 低。在 经 pH 为1.0及12.0缓冲液处理后,噬菌体 ФECP2-1完全失活(图7)。
2.5 噬菌体 ФECP2-1环境杀菌效果评估
2.5.1 液体杀菌效果评估
由表2可知,在液体条件下,浓度为1.0×104~1.0×106 PFU/mL的噬菌体 ФECP2-1 对 浓度1.0×105 CFU/mL 的 宿主菌杀菌率均在99.9%以上,且杀菌率随着噬菌体浓度的增加而 显 著 增 加(P<0.05),随 作用 时 间 的 延长杀菌率略有增加。说明该噬菌体在液体中具有较好的杀菌效果,可用于养殖环境中液体的消毒。
2.5.2 载体(鸡粪)杀 菌 效 果 评 估 结 果
由 表3可知,浓度 为2.0×104 ~2.0×106 PFU/g 的 噬菌体 ФECP2-1 对 鸡粪 中 浓 度 为2.0×105 CFU/g的宿主菌均具有 杀 菌 效 果,杀 菌 率 均 在99.0%以 上。杀菌率随着噬菌体浓度的增加显著增加 (P <0.05),随作用时间的延长杀菌率略有增加。说明该噬菌 体 针 对 鸡 粪 中 的 宿 主 菌 也 具 有 一 定 的 杀 菌效果。
3 讨 论
目前养殖业中关于禽大肠杆菌病的防控手段仍主要采用抗生素疗法,但大肠杆菌极易对抗生素产生耐药性,进而增强该菌的致病力,给养禽业带来更大的经济损失[12]。针对细菌耐药性问题,相关部门也出台了一系列限抗禁抗政策,在这种情况下,寻求新的防控手段成为一种必然。噬菌体以其独特的生物学特性及在防控细菌性疾病方面的巨大优势及潜力而备受关注[13]。
本研究以禽大肠杆菌 CVCC1552为宿主菌,从山东泰安某养鸭场粪污样品中分离得到1株具有较宽 裂 解 谱 的 禽 大 肠 杆 菌 噬 菌 体,将 其 命 名 为 ФECP2-1。该噬菌体在双层平板上形成的噬菌斑清晰、透亮,且在噬菌斑周围形成较大的环形晕圈。晕圈的形成被认为是由噬菌体产生的一种具有多糖降解能力的解聚酶降解噬菌斑周边宿主菌多糖骨架而成。此外,晕圈的形成也被认为是噬菌体具有荚膜水解酶活性的指示器。以上结果说明该噬菌体不仅可裂解宿主菌,还可降解细菌生物膜,具有较强的杀菌能力[14]。
通过透射电镜观察噬菌体 ФECP2-1具 有正 多面体的头部和细而长的尾部结构,同时结合酶切鉴定结果,确定该噬菌体为双链 DNA、肌尾科噬菌体,这与现有文献[15-16]中报道的大肠杆菌噬菌体结构特征基本一致。
相关知识推荐:畜牧局职称论文发表如何选刊
根据噬菌体裂解谱的宽窄可将噬菌体分为宽谱噬菌体和专一性噬菌体。自然界中大部分噬菌体专一性较强,只能特异性裂解某一细菌的某一血清型,但为了应对当前养殖行业中出现的病原菌混合感染,筛选宽谱噬菌体具有重要应用价值[17]。噬菌体 ФECP2-1可裂解多种来源且不同血清型的大肠杆菌,裂解谱宽于吴圆圆等[18]报道的鸡大肠杆菌噬菌体的裂解谱,说明该噬菌体可与多种细菌表面受体相结合进而裂解细菌,具有较高的应用价值。
噬菌体 ФECP2-1最佳感染复数为0.00001,表明噬菌体对宿主菌 CVCC1552极度易感。潜伏期为20~40min,对宿主菌的裂解量为4133PFU/cell,远高于魏炳 栋 等[19]报道的大肠杆菌噬菌体裂解量370PFU/cell。说 明 该 噬 菌 体 具 有 较 强 的 裂 解 能力,适于投入生产使用,提高噬菌体的生产效率。
温度和pH 的变化对噬菌体滴度也具有不同程度的影响。噬菌体 ФECP2-1的温度及pH 稳定性结果显示,在60℃及以下温度条件下噬菌体滴度相对稳定,高 于 此 温 度 则 滴 度 骤 降。这 一 结 果 与 杨 慧 敏等[20]报道的鸡大肠杆菌噬菌体在60 ℃作用20min噬菌体全部失活不 同。说明本研究分离到的禽大肠杆菌噬菌体温度耐受性更强,这一性能更有利于噬菌体制剂的商品化。噬菌体 ФECP2-1在pH3.0~11.0范围内滴度较稳定,这一结果也优于文献报道的同类噬菌体的酸碱耐受范围[21-22]。说明该噬菌体在不同的酸碱环境中均具有裂解细菌的能力,这一特性对于噬菌体作为环境消毒剂进行开发具有重要意义。
O2血清型大肠杆菌是禽类常见的致病力较强且发病率较高的大肠杆菌血清型之一,可引起禽类的胸膜炎及 败 血 症[23]。在 实际生产中由于杂菌干扰、噬菌体施用及取样不均匀等因素的存在,以致于无法对某一特异性噬菌体的真实杀菌效果进行评估。本研究排除以上干扰因素的影响,较理想化的使用噬菌体 ФECP2-1针对处理过的养 殖 水 体 及 鸡粪中宿主菌进行防控,以最大程度的呈现噬菌体的真实杀菌效果。结果显示噬菌体干预组液体及粪便大肠杆菌活菌数较初始均有明显降低,杀菌率均在99%以上。其中 噬 菌 体 ФECP2-1针 对液 体 中 大 肠杆菌杀菌效果优于对鸡粪中大肠杆菌杀菌效果,这可能与2种基质中噬菌体与宿主菌的接触概率有一定关系,此外鸡粪中有机质对于噬菌体的杀菌效果也可能存在一定干扰。噬 菌 体 ФECP2-1对 鸡粪 中大肠杆菌杀菌效果仍略优于文献中报道的杀菌效果[24]。综上可知,噬菌体 ФECP2-1对于实验室模拟的养殖环境感染的大肠杆菌具有良好的防控效果。
4 结 论
本研究从养殖环境中分离筛选到1株禽大肠杆菌 O2血清型强裂解 性 噬 菌 体 ФECP2-1,属 于肌 尾科噬菌体,具有较宽的裂解谱及良好的热稳定性、pH 耐受性。该噬菌体感染复数低、裂解量高,在模拟养殖环境中表现出较好的杀菌效果,是一株具有较好应用前景的噬菌体。本研究为噬菌体类生物消毒剂的研发奠定了基础,为禽大肠杆菌病的防控提供了新的思路。——论文作者:李金敏1 ,高绪娜1,桑瑞新1,宫本芝2,徐海燕1,谷 巍1,郝木强1,兰江华1,王 红1
参考文献(References):
[1] 王 瑶,张耀东,易 正 飞,等.禽致病性大肠杆菌血清型、进化分群及毒力基因的分子流行病学调查[J].中国兽医科学,2020,50(9):1159-1166.WANG Y,ZHANG Y D,YIZ F,etal.Molecularepidemiologicalinvestigation on serotype,phylogeneticgroup and virulence genes of avian pathogenicEscherichia coli[J].Chinese Veterinary Science,2020,50(9):1159-1166.(inChinese)
[2] 马兴树,强慧勤,杨 锴.禽致病性大肠杆菌实验感染模 型 研 究 进 展 [J].中 国 畜 牧 兽 医,2020,47(12):4103-4118.MAXS,QIANG H Q,YANG K.AdvancesontheexperimentalinfectiousmodelsofavianpathologenicEscherichiacoli[J].China Animal Husbandry &Veterinary Medicine,2020,47(12):4103-4118.(inChinese)
[3] GUIDOC,MARTINJ,WOOD W,etal.Comparativegenomics of European avian pathogenic E.coli(APEC)[J].BMCGenomics,2016,17(1):960.
[4] KATHAYAT D,LOKESH D,RANJIT S,etal.Avian pathogenic Escherichia coli (APEC):Anoverview of virulence and pathogenesis factors,zoonotic potential, and control strategies[J].Pathogens(Basel,Switzerland),2021,10(4):467.
[5] 郝智慧,肖希龙,邱 梅,等.不同区域鸡大肠杆菌对抗菌药 的 耐 药 性 比 较[J].中 国 兽 医 科 学,2009,39(1):84-88.HAOZH,XIAO XL,QIU M,etal.Comparisonofresistance of Escherichia coli in chicken toantimicrobials in different regions[J]. ChineseVeterinaryScience,2009,39(1):84-88.(inChinese)
[6] FERRIOL G C,DOMINGO C P.Phagetherapyinlivestock and companion animals[J].Antibiotics(Basel,Switzerland),2021,10(5):559.
[7] 吕 霖,石 鑫,郭晓奎,等.耐药肺炎克雷伯菌噬菌体 JD902 的分离及生物学特性和安全性研究[J].上海交通大学学报(医学版),2019,39(12):1389-1393.LYUL,SHIX,GUO X K,etal.Isolation,biologicalcharacteristicsandgenomicsafetyassessmentofdrug-resistant Klebsiella pneumoniae phage JD902[J].JournalofShanghaiJiaoTong University (MedicalScience),2019,39(12):1389-1393.(inChinese)
[8] YEN M M,CAIRNSLS,CAMILLIA.AcocktailofthreevirulentbacteriophagespreventsVibriocholeraeinfectioninanimalmodels[J].NatureCommunications,2017,8:14187.
[9] SHAFIQULA S,SHAMIMA S,GLORIA R,etal.Oralphagetherapyofacutebacterialdiarrhea withtwocoliphage preparations:A randomized trialinchildrenfrombangladesh[J].EBioMedicine,2016,4:124-137

